沸石通常用于破坏臭氧,因为它可以加速将臭氧转化为氧气的过程。需要阳离子来平衡铝硅酸盐骨架的负电荷。含有硅和铝的四面体排列在三维框架中,形成相互连接的通道并形成具有大表面积的结构。
天然沸石的一些用途是:干燥;离子交换反应;某些反应的催化作用;气体分离。

干燥:干燥是指除去水分。沸石是干燥剂或干燥剂,它们可以去除大气中的水分。沸石 A 是一种合成沸石,通常用作洗涤剂中的软水剂。沸石 A 的分子式为 Na12(Al12Si12O48)27H2ONa+ 是平衡铝硅酸盐离子电荷的阳离子。铝硅酸盐离子的电荷 = 12 x +1 = 12+,铝硅酸盐离子的分子式为Al12Si12O4812+,沸石还含有27个结晶水(27H2O)。
松散的结晶水可以通过加热从沸石中排出:将无水沸石置于潮湿空气中会导致水被沸石吸收,因为系统试图根据勒夏特列原理重新建立平衡。
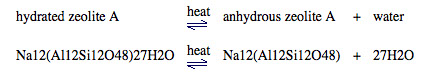
阳离子交换:在沸石结构的通道内,与沸石骨架离子键合的离子(例如 Na+)可以被带更多电荷的阳离子置换。
阳离子交换取决于:吸附强度,溶液中阳离子的相对浓度。
![]()
水软化:含有 Ca2+ 或 Mg2+ 的硬水可以通过装有钠沸石 NaZ 的柱子。双正 Ca2+ 或 Mg2+ 阳离子将 Na+ 离子从沸石颗粒骨架内的通道中置换出来:
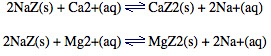
Na+ 不会像 Ca2+ 或 Mg2+ 那样与肥皂形成沉淀,所以水已经软化了。由于阳离子交换是平衡反应,因此可以通过使浓氯化钠溶液或盐水通过沸石来再生钠沸石。根据 Le Chatelier 原理,增加 Na+(aq) 的浓度会使平衡位置向左移动,有利于钠沸石的重新形成并将 Ca2+ 或 Mg2+ 释放回溶液中。
控释氮肥:尿素是一种常见的水溶性氮肥,可以通过根区浸出。尿素通过在许多土壤中发现的酶脲酶转化为氨。
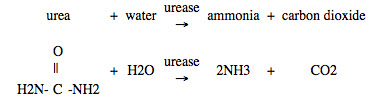
氨与土壤中的水反应形成铵离子:
![]()
土壤细菌将铵离子转化为硝酸根离子,硝酸根离子很容易从土壤中浸出。
沸石可用于通过三种方式减少这种含氮养分的损失:尿素可以包含在沸石框架内,防止尿素渗入根区。沸石骨架中含有的尿素减缓了土壤细菌将尿素转化为铵离子的速度。铵离子吸附到沸石的通道中可以保护它们免受硝化细菌的侵害,硝化细菌会将它们转化为可浸出的硝酸根离子。随着时间的推移,铵离子会缓慢地释放到土壤中。
控释氮肥:含有交换离子如铵的沸石可以与磷酸盐矿物(如磷灰石、磷酸钙)混合以生产控释磷肥。沸石从磷灰石中吸收 Ca2+ 并将磷酸盐和铵离子释放到土壤中:
![]()
当磷酸盐被植物吸收时,沸石将释放更多的磷酸盐和铵离子,以试图根据勒夏特列原理重新建立平衡。
催化:氢离子 H+ 可以结合到沸石结构中以实现电荷补偿。这些氢离子与桥接氧结合,形成酸性基团。这些沸石的行为类似于酸,可以在其通道内引发一系列化学反应。只有特定形状的分子才能进入和离开沸石中的通道,因此沸石催化剂被认为是形状选择性的。










